适用于从各种琼脂糖凝胶中回收100bp-10 kb 的DNA
·20-30分钟内即可完成凝胶中DNA的回收。
·最高可以达到85%的回收效率。
·核酸纯化柱无须平衡液处理,可最大吸附10μg DNA。
·溶液中所含的pH指示剂可直观地判断溶液中DNA与硅胶膜的最适宜结合条件。
·可用30 μl微量洗脱体积洗脱DNA。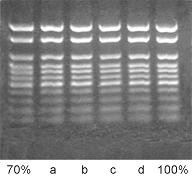
右图:
30 μl 100 bp DNA Marker加入到120μl融化的1.5%琼脂糖凝胶中制成含有不同长度DNA片段的凝胶块,经Simgen 凝胶DNA回收试剂盒(I型)回收DNA后,用30 μl Buffer TE洗脱(a, b, c, d),与起始的DNA Marker(70%,100%)对照各个片段的回收效率。
1.5% TAE 琼脂糖凝胶电泳。
产品原理
特殊设计的融胶缓冲液可在溶胶的同时调整完成溶液中DNA与硅胶膜的最佳结合条件,溶液中的DNA经过离心步骤结合到纯化柱上,溶解的凝胶分子与其他等杂质则被过滤出去,结合在纯化柱上的DNA最后用TE溶液洗脱下来。
操作步骤
切下含有DNA的琼脂糖凝胶,加入溶胶缓冲液,将溶化后的凝胶溶液加入到核酸纯化柱中,经过离心步骤使DNA结合到纯化柱上。经清洗液洗涤一次纯化柱上的DNA后,DNA即可被TE溶液洗脱下来。
可适用的分子生物学实验
DNA测序
基因芯片分析
DNA连接与转化
限制性酶切
标记
微注射
PCR
体外转录
常见问题分析
1. 回收不到DNA或者DNA的回收效率低
可能的原因:
1)Buffer WG或Buffer WB中未加入无水乙醇,应按比例补加无水乙醇。如果是错误地加入了其他试剂,请向我公司技术部寻求帮助。
2)Buffer WG或Buffer WB中错误地加入了70%乙醇。请向我公司技术部寻求帮助。
3)DNA的洗脱效率差。参考说明书第3页柱纯化技术中的第4点“洗脱DNA”内容优化DNA的洗脱方案。
4)将溶液加入到纯化柱前应观察Buffer G或Buffer P是否保持着原来的橙黄色,如果溶液变为紫红色,必须加入约10 μl 3 M醋酸钠(pH 5.0)使溶液恢复至原来的橙黄色,否则将严重影响DNA结合到纯化柱上。
仅凝胶回收:
5)制作的凝胶从加样孔至DNA泳动方向呈现为一个降低的斜面,DNA在泳动的过程中大量地流失到电泳缓冲液中。制作琼脂糖凝胶时应注意放平制胶槽,并加入足够量的凝胶液。
6)凝胶没有完全被溶解,DNA仍保留在未溶解的凝胶中。在50°C溶胶时每隔2-3分钟请将离心管漩涡振荡数秒以帮助凝胶彻底溶解。
7)在凝胶溶解后的溶液中加入异丙醇出现雾状沉淀。出现该种现象主要是因为凝胶没有被彻底溶解,此时应注意不要省略后续的Bufffer G的洗涤步骤,并且加入BufferG到纯化柱中后室温静置1分钟,以增强对未溶解的凝胶的洗涤效果。
2. 回收的DNA生物学活性差
1) 回收的DNA中盐分残留量过高。向纯化柱中加入Bufffer WG或者Bufffer WB后,室温静置5分钟后再离心,可最大程度地洗去纯化柱上残留的盐分。
2) 回收的DNA中乙醇残留量过高。注意不可省略高速空离(14000 rpm 离心1分钟)步骤。
产品序号:2001050 /2001250
| 规格 |
价格 |
| 50次制备 |
150 |
| 50次制备 |
650 |